Ατομική μάζα: ιδιότροπα σχέδια
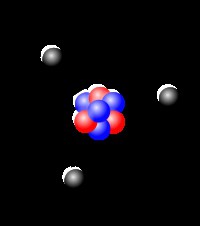
Αναφέρεται όλη η ποικιλία των υπαρχουσών ουσιώνσυνδυασμούς διαφορετικών τύπων ατόμων. Έτσι συνέβη ότι τα είδη αυτών των ατόμων - λίγο περισσότερο από εκατό σήμερα. Αλλά είναι πολύ ιδιότροποι τύποι, και ενώνουν το ένα με το άλλο όχι σύμφωνα με τους κανόνες της συνδυαστικής, αλλά σύμφωνα με τους νόμους της χημείας. Ακόμα, ο αριθμός των ουσιών είναι τεράστιος, αυξάνεται. Αλλά ο αριθμός των γνωστών χημικών στοιχείων σχεδόν δεν αυξάνεται. Κάθε ένα από αυτά είναι μοναδικό και έχει το δικό του «πορτρέτο». Και το κύριο χαρακτηριστικό κάθε στοιχείου είναι η ατομική μάζα.
Η μονάδα αυτής της μάζας είναι ένας πολύ μικρός αριθμός. Κανένας από τους διαθέσιμους τύπους ατόμων δεν ήταν ιδανικός ως υποψήφιος για να είναι μια μονάδα μάζας (αλλά το πλησιέστερο ήταν το ελαφρύ υδρογόνο). Ως αποτέλεσμα, οι επιστήμονες αποφάσισαν να πάρουν έναν βολικό αριθμό για υπολογισμούς - ένα δωδέκατο της απόλυτης μάζας ενός στοιχείου όπως ο άνθρακας. Αποδείχθηκε ότι αυτός ο αριθμός εκφράζει πολύ καλά τις αναλογίες στις οποίες τα άτομα των στοιχείων είναι μεταξύ τους. Έτσι, η μονάδα ατομικής μάζας αναγνωρίστηκε ως ένας αριθμός σε πολύ μικρό βαθμό, ένας μικρός αριθμός "δέκα στη δύναμη μείον είκοσι επτά".
Είναι σαφές ότι για να χρησιμοποιήσετε ακριβώς έναν τέτοιο αριθμόάβολα. Καταλαβαίνετε ότι, στους υπολογισμούς, αυτό μείον τον εικοστό έβδομο βαθμό δεν μεταφέρεται με το χέρι, και ως αποτέλεσμα, οι αριθμοί μπορούν να είναι εξίσου ενοχλητικοί και δυσκίνητοι. Τι να κάνετε Εφαρμόστε μια τέτοια μονάδα ως σχετική ατομική μάζα του στοιχείου. Τι είναι αυτό; Όλα γίνονται πολύ απλά - λαμβάνεται η απόλυτη ατομική μάζα (ο αριθμός είναι εξαιρετικά άβολος, σχεδόν με τον ίδιο μείον βαθμό), διαιρούμενο σε μια δωδέκατη μάζα άνθρακα. Λοιπόν τι Αυτό είναι σωστό, οι βαθμοί μειώνονται και αποδεικνύεται ένας αξιοπρεπής αριθμός. Για παράδειγμα, δεκαέξι για ένα άτομο οξυγόνου, δεκατέσσερα για το άζωτο. Ο άνθρακας, λογικά, θα έχει μάζα δώδεκα. Και η ατομική μάζα του υδρογόνου είναι μία, αν και όχι ακριβώς μία, που αποδεικνύει ότι δεν ήταν υδρογόνο που λήφθηκε για υπολογισμούς, αν και ο αριθμός είναι πολύ κοντά στη μάζα του.
Τότε γιατί είναι η σχετική ατομική μάζα του καθενόςστοιχείο - οι αριθμοί δεν είναι αρκετά όμορφοι, μη ακέραιοι; Το γεγονός είναι ότι τα στοιχεία, αν και είναι είδη ατόμων, στο πλαίσιο του είδους τους επιτρέπουν κάποια "ποικιλομορφία". Ορισμένες από αυτές είναι ασταθείς, με άλλα λόγια, καταστρέφονται πολύ εύκολα αυθόρμητα. Αλλά μετά από λίγο καιρό υπάρχει, επομένως, είναι αδύνατο να τα αγνοήσουμε. Συμβαίνει και ένας σταθερός συνολικός τύπος στοιχείων περιλαμβάνει υποείδη με διαφορετικές ατομικές μάζες. Ονομάζονται ισότοπα. Αυτό σημαίνει στην μετάφραση ότι καταλαμβάνουν ένα κελί του πίνακα που είναι γνωστό σε κάθε μαθητή - ναι, μαντέψατε σωστά, τους περιοδικούς πίνακες.
Αλλά μια ατομική μάζα κάνει ένα στοιχείο ένα στοιχείο; Καθόλου, το στοιχείο χαρακτηρίζεται από έναν πολύ πιο θεμελιώδη αριθμό πρωτονίων στον πυρήνα. Εδώ δεν μπορεί να είναι κλασματικό και σημαίνει θετικό πυρηνικό φορτίο. Το "ήσυχο" άτομο έχει τόσα ηλεκτρόνια με τα πρωτόνια στον πυρήνα και επομένως το άτομο που σέβεται τον εαυτό του είναι ηλεκτρικά ουδέτερο. Σύμφωνα με την ευθύνη του πυρήνα, τα άτομα είναι διατεταγμένα σε μια ακολουθία στον περιοδικό πίνακα, αλλά οι μάζες τους μερικές φορές δεν υπακούουν σε αυτόν τον νόμο. Επομένως, υπάρχουν περιπτώσεις εξαιρέσεων, όταν το βαρύτερο άτομο στην ακολουθία του πίνακα είναι νωρίτερα. Λοιπόν, τα ισότοπα είναι τα μόνα που κατηγορούν. Η φύση "ήθελε" ότι θα υπήρχαν πολλά βαριά ισοτόπια γι 'αυτό το στοιχείο. Αλλά η σχετική ατομική μάζα ορίζεται ανάλογα με τις ποσότητες διαφορετικών ισοτόπων. Με απλά λόγια, αν υπάρχουν περισσότερα βαριά ισοτόπια στη φύση - η ατομική μάζα θα είναι μεγαλύτερη, αν υπάρχει περισσότερο φως, τότε μικρότερη. Έτσι παίρνουν τα παράδοξα του συστήματος Mendeleev.
Στην πραγματικότητα, αυτό που λέγεται για την ατομική μάζακάπως απλουστευμένη. Υπάρχουν βαθύτερες και πιο σοβαρές τακτικές όσον αφορά τον περιοδικό πίνακα. Αλλά απαιτούν ένα ξεχωριστό άρθρο, ίσως θα επιστρέψουμε στην αντίληψή τους αργότερα, αγαπητός αναγνώστης.
</ p>>